CIENCIA
Quimica
supramolecular
La quimica sintetica
produce moleculas principalmente a traves de una red de enlaces covalentes.
La quimica organica
tiene como una de sus metas principales el desarrollo de metodos para formar
este tipo de enlaces; esto ha hecho posible la sintesis total de moleculas
complejas que constituyen grandes triunfos de la metodologia sintetica; sin
embargo, la quimica organica
sintetica no puede generar ni grandes moleculas con una compleja estructura
terciaria como las macromoloculas biologicas, ni moleculas con capacidad para
responder a estimulos fisicos y/o quimicos. En este punto surge la quimica
supramolecular. Esta ciencia, aun joven, ofrece la posibilidad de realizar este
trabajo complejo; consecuentemente amplia el campo de investigacion de la quimica.
El objetivo de este trabajo es mostrar cual es el campo de la quimica
supramolecular y la relacion que existe entre esta y la quimica organica
clasica.
La
quimica supramolecular(supra :palabra latina que significa por
encima,mas que) se ocupa del
diseno, la sintesis, y el estudio de estructuras moleculares unidas por uniones
no covalentes,las estructuras de este tipo estan presentes en la
naturaleza .
La
capacidad de las macromoleculas biologicas ,como las proteinas y el ADN para
reconocer selectivamente y unirse a otras especies para formar complejos mas
grandes, supramoleculares, es un elemento clave en la quimica de la
naturaleza. Los quimicos actualmente estan cada vez mas interesado en imitar
estos procesos que implican el reconocimiento molecular de una molecula por otra, por medio
de la formacion de uniones no covalentes que las vinculan entre ellas, la union
espontanea de dos a muchos miles de moleculas en sistemas definidos como
supramoleculares, presentan nuevas propiedades quimicas.
Aplicaciones industriales importantes ya incluyen el
diseno de medicinas, la sintesis de polimeros estereos-regulares, la
cromatografia, el crecimiento epitaxial y los presentadores de cristal liquido. Las palabras clave son:
autoorganizacion, interacciones intermoleculares, quimica supramolecular,
reconocimiento molecular.
El
termino supramolecular,fue introducido en 1978 por Jean-Marie Lehn, se refiere
a los conjuntos ordenados de moleculas que se mantienen unidos por
interacciones no covalentes, como las uniones metal-ligand(en ingles), uniones
de hidrogeno(hydrogen bonds), o las fuerzas de van der Waals. Debido a lo debil
de las interacciones, la formacion supramoleculares estan sujetas al estado
termodinamico del sistema, por lo que comunmente son generadas espontaneamente
por auto-organizacion mas bien que por uniones secuenciales.
Poco despues de
la publicacion de los eteres corona, J. -M. Lehn sintetizo un nuevo tipo de
estructuras, y se adentro en lo que mas tarde el denominaria "quimica supramolecular",
tratando de describir estructuras que sobrepasaban las moleculas sencillas
unidas por enlaces covalentes. Quizas el primer ejemplo de tales estructuras
fue el simple complejo formado por un eter
corona, y la union de un metal
alcalino. Los eteres son en general poco
reactivos y se utilizan como disolventes. Pero existen algunos con unas
propiedades espectaculares. Son los denominados eteres corona que fueron
descubiertos por Pedersen en 1967.
Clases de interacciones supramoleculares.
Interacciones
electrostaticas,de un ion con otro ion o de ion con un dipolo,un caso especial
es la union hidrogeno.
La atraccion de Coulomb entre cargas opuestas es un principio de interaccion en la quimica supramolecular,un ejemplo es la coordinacion de un cation en un ligante macrociclico (ligand Etymology: Latin ligandus, gerundive of ligare),p. ej. K+ unido a 18-corona-6 ver este enlace:

Este ultimo caso
es una interaccion ion-dipolo,el aspecto complementario es que el cation esta
unido a la parte negativa del dipolo(a los atomos de oxigeno).
Otro ejemplo que
se encuentra en la naturaleza,de la coordinacion del ion potacio K+ a la valinomicina,una
estructura ciclica,un antibiotico que actua como transpote de un ion,producida
por la Streptomyces,el cual
transporta selectivamente el ion potacio atraves de una membrana,destruyendo el
gradiente de concentracion de este ion.

La union
hidrogeno, puede ser del tipo
dipolo-dipolo o dipolo-ion. La union hidrogeno se forma,cuando el atomo de
hidrogeno esta compartido entre dos moleculas. Para entender el enlace del
hidrogeno, es importante considerar el caracter unico del atomo del hidrogeno.
Consiste en un proton (el nucleo) y un solo electron.
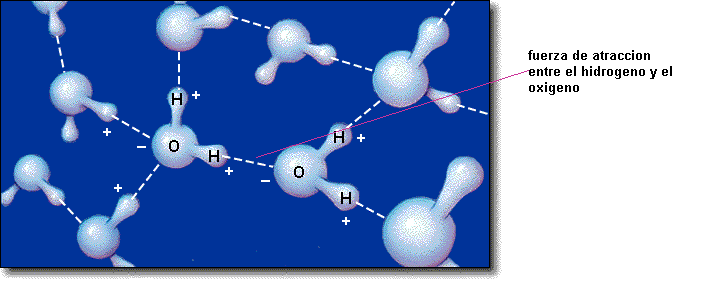
Cuando uno de los atomos positivamente cargados del
hidrogeno de una molecula de agua es atraido por el atomo de oxigeno cargado
negativamente de otra molecula de agua, el proton puede estar muy cerca de este
atomo de oxigeno y es atraido fuertemente. Esta interaccion fuerte se llama enlace
de hidrogeno. En general, un enlace de hidrogeno se forma entre un atomo de
hidrogeno que es adherido a un atomo muy electronegativo,tal como el
nitrogeno,el oxigeno o el fluor.
Los enlaces covalentes son importantes en la materia , porque unen los átomos de las moléculas de una célula. Pero la union entre las moléculas es también importante, especialmente en la química de la célula, donde las características de la vida emergen de interacciones moleculares. Cuando dos moléculas en la célula se asocian, pueden adherirse temporalmente por tipos de uniones químicas que son mucho más débiles que los enlaces covalentes. La ventaja de los enlaces débiles es que el contacto entre las moléculas puede ser breve; las moléculas se unen, responden mutuamente de una cierta manera, y después se separan. Varios tipos de uniones químicas débiles permiten a las moléculas de la célula asociarse. Uno es el enlace iónico, que es relativamente débil en presencia del agua. Otro tipo de enlace débil que funciona en la materia viva es el enlace del hidrógeno.
Los enlaces de hidrógeno, los enlaces iónicos, y otros enlaces débiles se forman no solamente entre las moléculas,sino también pueden formarse entre diversas regiones de una gran molécula, como una proteína. Aunque estos enlaces son individualmente débiles, su efecto acumulativo es reforzar la forma tridimensional de una molécula grande.
La union hidrógeno se da en las interacciones que determinan la forma de una proteínas y de la información genética en la molecual ADN y ARN(2).
La doble helice.
La molécula del ADN es una doble helice, con una columna vertebral del azucar-fosfato de los polinucleotidos en el exterior de la hélice. En el interior están los pares de bases nitrogenadas, sosteniendo las dos hebras juntas por los enlaces de hidrógeno. La base adenina se une solamente con la base timina, y la base guanina se une solamente con la base del citosina(3).
Enlaces
relacionados :
ETER CORONA
, http://ar.geocities.com/moni2201/eter_corona.htm
(2)
(3)Estructura del
ADN.(acido desoxirribonucleico), http://ar.geocities.com/moni2201/estructura_adn.htm
Eduardo Ghershman,28.5.2002
enlace a CIENCIA